気体の法則
ここでは理想気体について考えています。
理想気体とは
- 分子の大きさが無視できる
- 分子間力が $0$
ような気体で、本記事で述べるボイルとシャルルの法則に厳密に従います。
断熱変化・ポアソンの法則については次の記事を参照してください。

ボイル・シャルルの法則
ボイルの法則
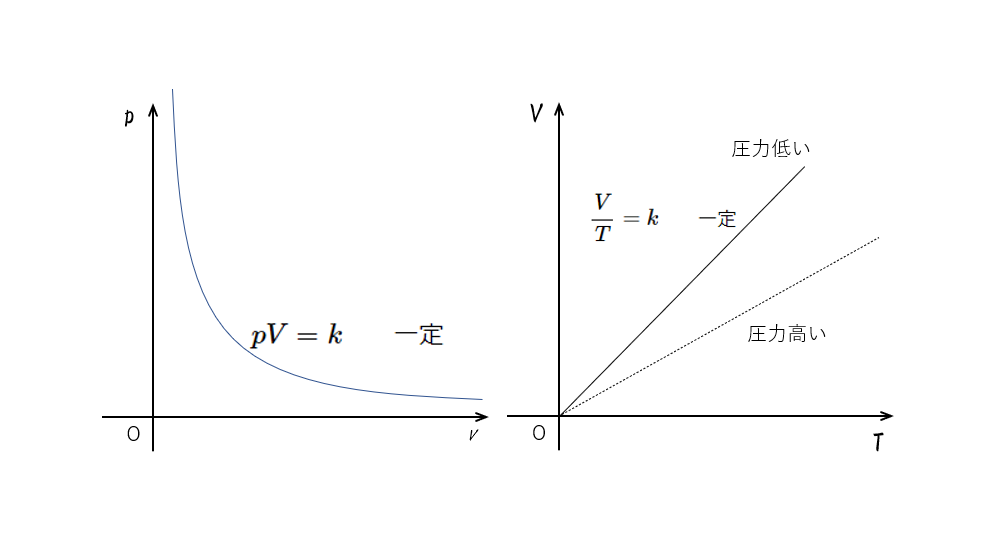
温度 $T$ が一定のとき、一定質量の気体の体積 $V$ と圧力 $p$ は反比例する
$pV=k\:\:\:\:\:\:\:\:$一定
このとき、縦軸に圧力 $p$ を、横軸に体積 $V$ をとってグラフを描くと、図のようになります。( $xy=k$ のグラフと同じことです)
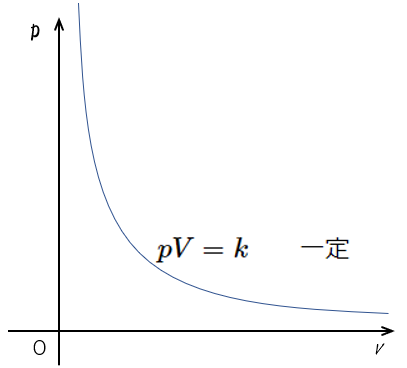
これは反比例関係を示していますね。
温度一定が前提条件であることに注意してください。
これを等温曲線といいます。
シャルルの法則
圧力 $p$ が一定のとき、一定質量の気体の体積 $V$ は絶対温度 $T$ に比例する
$\dfrac{V}{T}=k\:\:\:\:\:\:\:\:$一定
このとき、縦軸に体積 $V$ を、横軸に絶対温度 $T$ をとってグラフを描くと、図のように原点を通る直線となります。( 変形すると $V=kT$ となりますから、これは $y=kx$ のグラフと同様です。つまり比例関係です)
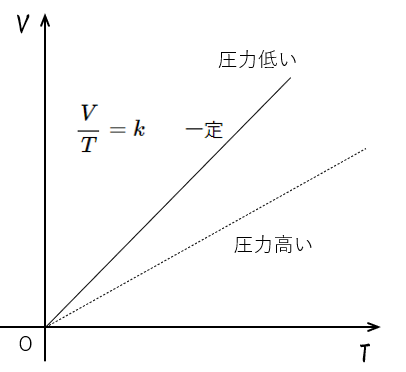

すごく大事な注意点があります。
それは、この圧力一定のグラフは
$V=kT$
と示すことができますから、
グラフは必ず原点を通ります!
そして、 $V=\frac{k’}{p}T$ ともできるので、
圧力が高いときのほうがグラフの傾きは小さくなります。
そんなの当たり前じゃん!・・と思ったかもしれませんが、このことを意識しておくとグラフの選択問題や作図が、簡単にできる場合が多いのですよ。
ボイル・シャルルの法則
一定質量の気体体積 $V$ は、気体圧力 $p$ に反比例し、絶対温度 $T$ に比例する
$\dfrac{pV}{T}=k\:\:\:\:\:\:\:\:$一定
ボイルの法則とシャルルの法則・・二つを一つにしちゃえ!
ということで、ボイル・シャルルの法則と呼ばれています。
ここで、 $pV=kT$ と変形してみます。
そうすると、絶対温度 $T$ が高いほど $pV$ の値が大きくなります。
また・・・当たり前のことを・・・と思われますか?
でも、例えば、縦軸に圧力 $p$ を、横軸に体積 $V$ をとると、次のような絶対温度別のグラフを描くことができます。等温曲線です。

おわかりでしょうか?
このグラフでは、右上に行くほど温度が高いのです。
熱力学でよく使われるグラフの一つがこの $p-V$ 図です。
このグラフの等温曲線を理解できていれば、絶対に有利です。
必ず、理解しましょう。
理想気体の状態方程式
標準状態
標準状態についておさらいしておきましょう。
温度 $0\:\:^{\circ}C=273\:\:K$ 、圧力 $1.013\times 10^5\:\: Pa\:\:=1\:\:atm$ である状態です。
このとき、モル数が $n=1$ モル である理想気体の体積は $22.4 \:\:L=2.24\times 10^{-2}\:\:m^3$ です。
気体定数
さて、ボイル・シャルルの法則である、 $\dfrac{pV}{T}$ について、具体的な数値を代入してみます。
\begin{eqnarray}
\dfrac{pV}{T}&=&\dfrac{1.013\times 10^5 \times 2.24\times 10^{-2}}{273}\\\\
&=&8.31\:\:\dfrac{Pa\cdot m^3}{mol\cdot K}\\\\
\end{eqnarray}
この値は、 $\dfrac{pV}{T}$ が一定であるわけですから、一定質量の気体でありさえすれば、圧力や体積、温度が変化しても同じはずです。
したがって、この値を気体定数 $R$ としてすべての気体について適用します。
$R=8.31\:\:\dfrac{Pa\cdot m^3}{mol\cdot K}$
理想気体の状態方程式
気体定数 $R$ を用いると、ボイル・シャルルの法則は次のようになります。
$\dfrac{pV}{T}=R$
気体定数 $R$ は $n=1$ モル について考えているので、もし気体が $n$ モル ある場合は、
$\dfrac{pV}{T}=n \times R$
ですね。したがって、
$pV=nRT$
と書くことができます。
理想気体の状態方程式
圧力 $p$ 、体積 $V$ 、 モル数 $n$ 、 絶対温度 $T$ 、 気体定数 $R$ としたとき、
$pV=nRT$
が成り立つ。
断熱過程で成り立つポアソンの式については以下を参照してください。











コメント