定積モル比熱と定圧モル比熱って習いましたね。
これがなかなか手ごわいと思った人もみえるのではないでしょうか。
いまさら聞けない!定積モル比熱はいつでも使えるの?
定積モル比熱はその名前が「定積」となっているため、定積変化限定だと思っている人も見えますね。
しかしその名に反して、定積モル比熱はいかなる状況下でも使えるのです。
今回はこのことについて考えていきましょう。
まずは比熱のおさらいから。
モル比熱とは
モル比熱の概念は特に難しいことはありません。
単純に比熱を気体に拡張しただけです。
比熱のおさらいをしましょう。
比熱 $c \:[\mathrm{J/mol\cdot K}]$ とは、物質を $1\:\mathrm{g}$ 温めて(冷やして)温度を $1\:\mathrm{K}$ だけ変化させるための熱量 $\mathrm{[J]}$ のことですね。
したがって、質量 $m$ の物質に $Q$ のエネルギーを与えて、温度が $\Delta T$ 上昇したとすると、比熱 $c$ は次の式で表されます。
$c=\dfrac{Q}{\Delta T}\cdot\dfrac{1}{m}$
まず、$\dfrac{Q}{\Delta T}$ として $1\:\mathrm{K}$ だけ温度を上げる(下げる)ために必要な熱量を求めます。その上でさらに、質量 $m\:[\mathrm{g}]$ で割ることで、物質を $1\:\mathrm{g}$ 温めて(冷やして)温度を $1\:\mathrm{K}$ だけ変化させるための熱量 $[\mathrm{J}]$ がわかります。
似たものに熱容量 $C$ がありますが、こちらは質量 $m$ で割りません。
したがって、$C=mc$ ということになります。
モル比熱とはこの質量 $m$ で割る、という作業を、モル数 $n$ で割ることにした・・・というだけの話です。
気体の性質として、気体の種類によらず同温・同体積では同数の気体分子を含みます。
したがって、単原子分子理想気体同士であれば、気体のモル比熱は物質の比熱のように物質によって違う値をとらずどれも同じということになります。
ちなみに、二原子分子同士であっても、同じように決まった値を取ります。
(二原子分子以上では気体のエネルギーを考えるときに、回転のエネルギーが付加されるのでそれぞれ違った値を取ることになるのです。)
よって、モル比熱 $c$ の基本的な考え方を式に示すと次のようになります。
ただし、$n$:モル数
$c=\dfrac{Q}{\Delta T}\cdot\dfrac{1}{n}$
しかし話はそれだけでは終わりません。
気体は、温度により体積変化が大きいので、圧力一定の変化と体積一定の変化では大きな熱量のちがいが出てきます。

例をあげましょう
注射器に詰めた気体を温める場合、ピストンを固定したほうが自由にピストンが動くときよりも温度が上がりやすくなります。
なぜならピストンを固定した場合は、ピストンを動かす仕事をしなくても良く、エネルギーすべてを気体の温度を上げるために使えるためです。
そこで、2つの変化 定圧変化(圧力一定で変化:体積は変化する)と定積変化(体積一定で変化:圧力は変化する)についてそれぞれ比熱を設定していきます。
定積モル比熱 $C_V$
では、体積一定の場合のモル比熱、定積モル比熱 $C_V$ について考えます。
状況としては缶詰のような体積の変化しない容器に気体を詰め込んだ場合を考えます。
このとき、気体は膨張しませんから、気体のする仕事 $W$ は $0$ です。
熱力学第1法則より、$Q=\Delta U+W_{(=0)}=\Delta U$ ですね。
したがって、定積モル比熱 $C_V$ は比熱の定義から次のようになります。
$C_V=\dfrac{Q}{\Delta T}\cdot\dfrac{1}{n}$
$~~~~=\dfrac{\Delta U}{n\Delta T}$
よって、
$\Delta U=nC_V\Delta T$
です。
定圧モル比熱 $C_p$
圧力一定のもとで変化する場合について定圧モル比熱を考えましょう。
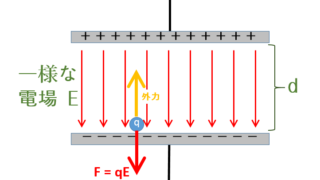
状況としては、摩擦なく動くピストンをもつシリンダーに閉じ込められた気体を考えます。
注射器を想像してください。
この場合、気体に熱を与えるとピストンが移動します。
その移動は十分ゆっくりであるとすると、ピストンが動いている以上、気体の体積は増減しますが、中の圧力は一定に保たれています。
これが定圧変化です。
$Q$:熱量、気体のモル数を $n$ とすると、比熱の定義から定圧モル比熱 $C_p$ は、
$C_p=\dfrac{Q}{\Delta T}\cdot\dfrac{1}{n}$
したがって、
$Q=nC_p\Delta T$
となります。
マイヤーの関係式

圧力 $p$ 一定とすると、熱力学第1法則から
$Q=\Delta U+p\Delta V$
ですね。
そこで、この式を定圧モル比熱の式に代入しましょう。
$C_p=\dfrac{\Delta U+p\Delta V}{\Delta T}\cdot\dfrac{1}{n}$
$~~~~=\dfrac{\Delta U}{n\Delta T}+\dfrac{p\Delta V}{n\Delta T}$
ここで $C_V=\dfrac{\Delta U}{n\Delta T}$ だから
$C_p=C_V+\dfrac{p\Delta V}{n\Delta T}$
圧力一定で体積が $V+\Delta V$ になり、温度が $T+\Delta T$ になったとすると、状態方程式から
$p(V+\Delta V) =nR(T+\Delta T )$ になります。ここで、$pV=nRT$ であるから、
$p\Delta V =nR\Delta T$
が言えます。
ゆえに、$\dfrac{p\Delta V}{n\Delta T}=R$ だから、
$C_p=C_V+\dfrac{p\Delta V}{n\Delta T}$
$C_p=C_V+R$
これをマイヤーの関係式といいます。
定積モル比熱はいつでも使えるか?

定積モル比熱の導出過程をもう一度考えてみましょう。
定積モル比熱 $C_V$
気体のする仕事 $W=0$
したがって、熱力学第1法則より、$Q=\Delta U+W_{(=0)}=\Delta U$
定積モル比熱 $C_V$ は比熱一般の定義より、
$C_V=\dfrac{Q}{\Delta T}\cdot\dfrac{1}{n}$
より、
$\Delta U=nC_V\Delta T$
つまり、ある気体がある変化をして温度が $\Delta T$ 変化した場合の内部エネルギーの変化分を計算しているということです。
定積モル比熱 $C_V$ は、いつでも使えます。
ボルツマンの考察にあったように、理想気体の内部エネルギーは、気体分子の運動エネルギー総和だけで決まります。これらは、気体の温度を意味します。
要するに、途中の状態変化の様子は問わず、ある温度のときの気体分子の運動エネルギー総和が問題なわけです。
ということは、気体の内部エネルギーは温度だけで決まるといえます。
つまり、$\Delta U$ は、温度変化 $\Delta T$ だけがわかればよく、あとはどうでもいいのだと言うことになるのです。
単原子分子の場合、$\Delta U=\dfrac{3}{2}nR\Delta T$ でしたから、これを代入すると
単原子分子理想気体では、
$\Delta U=\dfrac{3}{2}nR\Delta T=nC_V\Delta T$
ゆえに、
$C_V=\dfrac{3}{2}R$
となります。
また、マイヤーの関係式から単原子分子理想気体では
$C_p=C_V+R$
$~~~~=C_V+\dfrac{3}{2}R$
$C_p=\dfrac{5}{2}R$
です。
まとめ
- 定積モル比熱 $C_V$ は内部エネルギー変化で決まり、そして内部エネルギーは温度だけで決まるため、いつでも使用できます。
$\Delta U=nC_V\Delta T$
$Q=nC_p\Delta T$
$C_p=C_V+R$
特に、単原子分子理想気体では
$C_V=\dfrac{3}{2}R$
$C_p=\dfrac{5}{2}R$
二原子分子理想気体では
$C_V=\dfrac{5}{2}R$
$C_p=\dfrac{7}{2}R$
エッセンスの次は良問・名問がおすすめです
Z会Asteria まずは無料でお試しください













コメント